项目文章|物种形成研究揭示峨眉锥栗的杂交起源和生殖隔离位点的非均匀分布
西双版纳植物园孙永帅团队在Nature Communications发表了题为Genomic basis of homoploid hybrid speciation within chestnut trees的研究论文,该研究以中国特有的峨眉锥栗研究系统为材料,应用进化生态基因组学研究方法,发现了一个树木杂交物种以及生殖隔离位点的分布式样。
物种形成模型可分为二歧分支式物种形成和杂交物种形成。二歧分支模型中,每个物种只对应一个祖先群体。杂交物种则源自于两个或多个类群。进一步地,杂交成种分为多倍体杂交成种和同倍体杂交物种形成。多倍体物种形成较常见于植物界。而同倍体杂交物种形成类群颇为少见。迄今,有5个认可度较高的同倍体杂交物种形成类群,均分布在美洲。
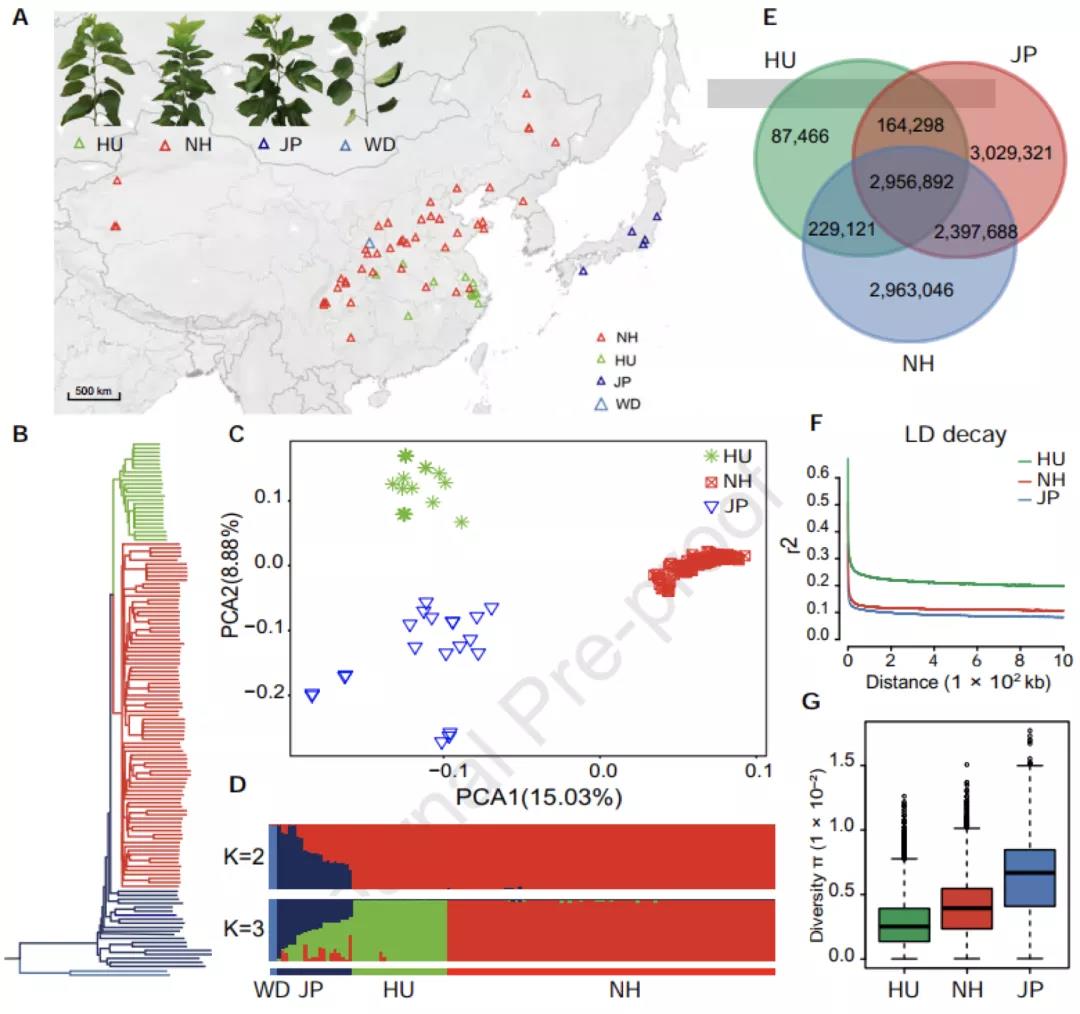
现存物种及类群间的生殖隔离强度往往高于其祖先群体间的隔离强度。孙永帅团队将这一原理引入到进化生态学与基因组学交叉研究中。即,在与生殖隔离关联的基因组区域上,现存类群间的基因流应低于其祖先群体间的基因流。在生殖隔离位点上,亲本物种的等位基因往往因环境、遗传限制而不能共存。基于这些原理,该团队应用群体基因组学方法鉴定了中华板栗(也称板栗)和锥栗的生殖隔离位点,进而用之检验峨眉锥栗是否起源于板栗和锥栗间杂交。与此前研究报道的5个同倍体杂交成种的实验设计不同,在峨眉锥栗杂交系统中,板栗和茅栗的姐妹种对关系为鉴定板栗和锥栗的生殖隔离位点提供了天然对照和便利(图1)。
该研究首先用多个方法分析峨眉锥栗与板栗、锥栗的遗传差异,为峨眉锥栗的分类地位提供了基因组学证据。然后,采用hhs方法、溯祖模型比较分析等对峨眉锥栗的杂交起源过程进行解析,并估算亲本物种对峨眉锥栗基因组的相对贡献。随后,该研究鉴定了与生殖隔离关联的候选基因组位点。在峨眉锥栗基因组中,仅6个生殖隔离位点来自于板栗。基因功能注释分析发现两个花期关联基因位于本研究鉴定的生殖隔离关联位点上。这些结果表明,亲本物种间生殖隔离位点的重新组合可为新物种形成的重要机制。深入分析发现,候选生殖隔离位点偏集中分布于基因组的低重组区域。研究认为,自然选择和遗传重组间互作塑造了峨眉锥栗基因组的进化过程。
西双版纳植物园植物进化生态学研究组孙永帅博士为研究论文的第一作者和通讯作者。该项研究得到了国家自然科学基金委,中国科学院和云南省的经费支持。
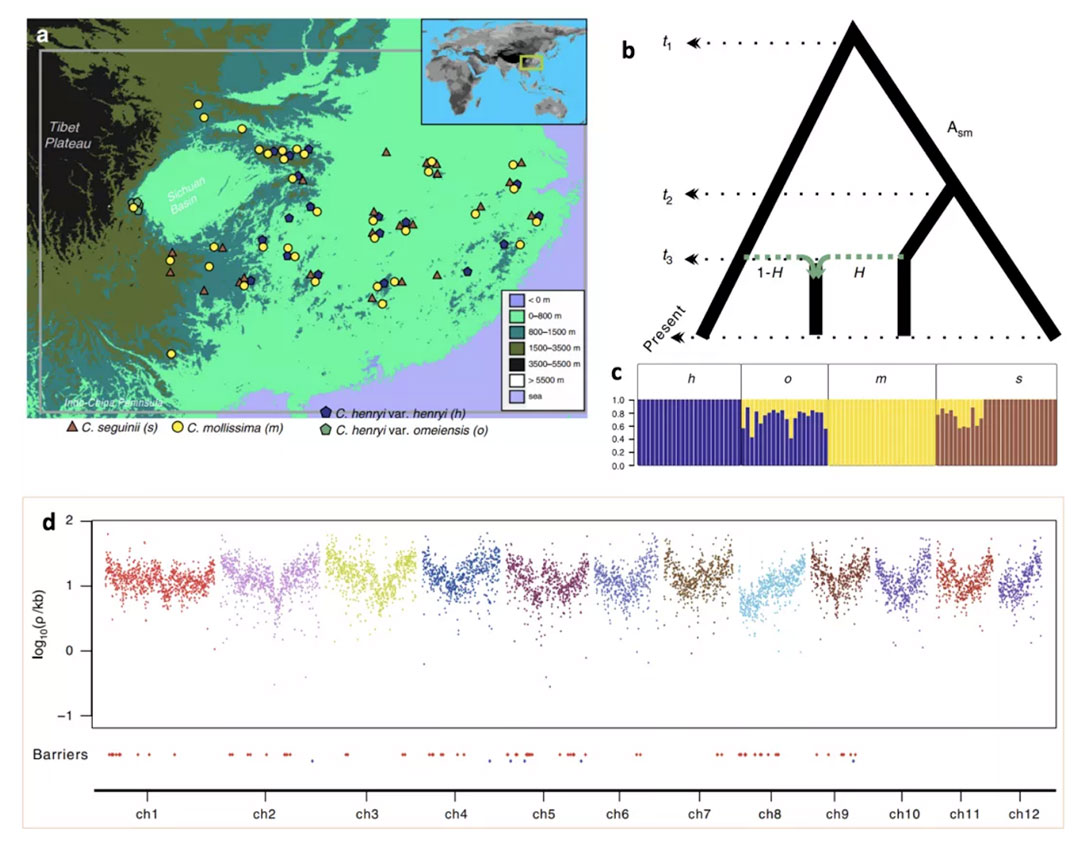
图1. 4个栗属Castanea类群的样品采集地(a)、演化关系(b)、遗传结构(c),以及板栗基因组的重组率分布以及生殖隔离位点的分布式样(d)